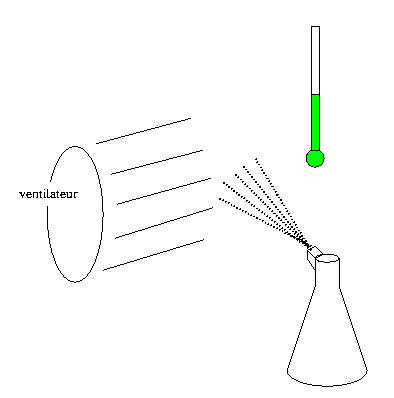
On place un ventilateur à une cinquantaine de centimètres d’un thermomètre. On remplit un brumisateur (lave - vitre...) d'eau tiède ou chaude. Si on vaporise cette eau dans le courant d'air du ventilateur, la température indiquée par le thermomètre baisse. Ainsi, bien que l'eau vaporisée soit chaude, l’énergie thermique absorbée lors de l'évaporation est suffisamment importante pour abaisser la température.
L'évaporation absorbe de l'énergie. Lorsqu'une gouttelette d'eau en suspension dans l'air s'évapore, elle prend l'énergie à l'air qui l'entoure. Ce phénomène est également présent dans la nature. Les gouttes de pluies qui tombent d'un nuage peuvent, durant leur chute, traversée de l'air plus sec, s'évaporer et refroidir l'air ambiant.
Pour évaporer un gramme d'eau, il faut fournir environ 6 fois plus d'énergie que pour chauffer ce gramme d'eau de 0°C à 100°C. L'importance de l'énergie thermique absorbée lors de l'évaporation est perceptible lors d'expériences banales. Lorsque l’on est mouillé, la sensation de froid est plus forte que lorsque l'on est sec à cause de l'évaporation de l'eau sur la peau. L'eau contenue dans une gourde poreuse (faite en cuir, en tissus...) est rafraîchie grâce à l'évaporation de l'eau qui humidifie les parois...
D'après La Physique du climat, J-L Dufresne, in "Graines de Sciences 2", pp.77-100, Edition Le Pommier, Paris, 2000.